Многие клетки млекопитающих, прежде чем приступить к пролиферации и образовать клеточный монослой, должны прикрепиться к субстрату и «распластаться» на нем. В качестве субстрата в настоящее время используют несколько материалов, самыми распространенными из которых являются стекло и пластик. Рост клеток в клеточной культуре связан с образованием множества адгезионных контактов между клетками и материалом посуды. Такие контакты осуществляются с помощью адгезионных белков – фибронектина, витронектина и др. Кроме того, адгезия клеток осуществляется за счет электростатических взаимодействий, поэтому поверхность культуральных сосудов должна быть смачиваемой и отрицательно заряженной.
Целью данного исследования было сравнение адгезии и пролиферативной активности двух клеточных культур (диплоидной линии клеток легкого эмбриона человека ЛЭЧ-4/81 и перевиваемой клеточной линии почки теленка MDBK) в зависимости от инкубирования в разных культуральных флаконах: стеклянных и пластиковых (швейцарской компании TPP и другого производителя).
Материалы и методы исследования
В работе использовали диплоидную линию клеток легкого эмбриона человека (ЛЭЧ-4/81) и перевиваемую клеточную линию почки теленка MDBK, любезно предоставленные лабораторией клеточных культур Екатеринбургского научно-исследовательского института вирусных инфекций. В качестве питательной среды использовали смесь сред Игла-DMEM и Игла 199 в соотношении 1:1 (производство ФГУ НИИ полиомиелита и вирусных энцефалитов им. М.П. Чумакова, Москва) с добавлением 10% эмбриональной телячьей сыворотки ЭТС (НПО «ПанЭко», Москва). При пересеве культуры клеток питательную среду из флаконов сливали, монослой клеток заливали теплым раствором Версена-Трипсина (1:1) температурой 20-37°С в объеме 10-15 мл на 6-10 минут. Затем раствор Версена-Трипсина сливали и вносили питательную среду в объеме 5 мл и взбалтывали. 1 мл клеточной культуры отбирали для подсчета клеток в камере Горяева. Исходя из полученных при подсчете данных делали разведение с целью получения 80-100 тыс. клеток/мл в посадочной клеточной культуре. Клеточные культуры инкубировали в пластиковых флаконах двух видов: TPP (Швейцария) и другого производителя, площадью по 25 см2 (рис. 1). В качестве контроля использовали стеклянные флаконы.

Рис. 1. В каждый флакон вносили по 10 мл клеточной культуры MDBK с посадочной концентрацией 88 тыс. клеток/мл. Для исследования использовали 3 вида разных флаконов: 1,2 – стеклянные флаконы; 3,4,5,6 – пластиковые флаконы.
Флаконы с культурой клеток расчерчивали по диагонали для определения полей подсчета. Индекс адгезии (прилипания) клеток (ИАК) определяли через 24 часа инкубирования по формуле 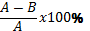 , где А – посадочная концентрация клеток в 1 мл; В – концентрация клеток в 1 мл ростовой среды через 24 часа инкубирования. Индекс пролиферации определяли как отношение количества клеток через 48 часов (К2) к количеству клеток через 24 часа (К1) по формуле К2:К1.
, где А – посадочная концентрация клеток в 1 мл; В – концентрация клеток в 1 мл ростовой среды через 24 часа инкубирования. Индекс пролиферации определяли как отношение количества клеток через 48 часов (К2) к количеству клеток через 24 часа (К1) по формуле К2:К1.
Результаты исследования и обсуждение
Посадочные концентрации клеточных культур составляли 88 тыс. клеток/мл и 180 тыс. клеток/мл для MDBK и ЛЭЧ-4/81, соответственно. При микроскопии флаконов с культурой клеток ЛЭЧ-4/81 после 24 часов инкубирования выявлено образование однородной популяции веретенообразных клеток с некоторым количеством не прикрепившихся к субстрату округлых клеток (рис.2).
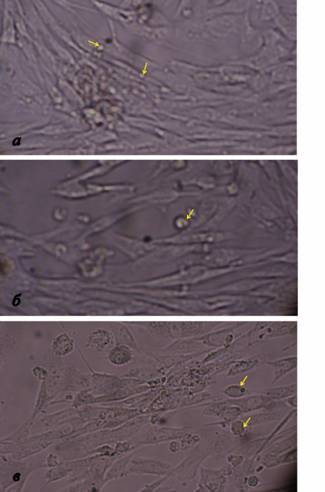
Рис. 2. Микроскопия ЛЭЧ-4/81 после 24 часов инкубирования в флаконах TPP (а), флаконах другого производителя (б) из пластика и стеклянных флаконах (в). После того, как клетки ЛЭЧ «распластались» по субстрату, они принимают веретенообразную нативную форму. Желтые стрелочки указывают на округлые неприкрепившиеся клетки.
Индекс адгезии клеток ЛЭЧ-4/81 культивируемых в пластиковых флаконах был почти одинаковым и составлял 73,3% и 73,5% для TPP и аналогичной посуды другого производителя, соответственно (таблица 1). Этот показатель несколько превышал значение индекса адгезии ЛЭЧ-4/81 инкубируемых на стеклянном субстрате, который составлял 66,7%.
Таблица 1. Индекс адгезии ЛЭЧ-4/81 в трех параллелях.
| № пробы | Стеклянный флакон | Пластиковый флакон другого производителя | Пластиковый флакон ТРР | |||
| В 103кл/мл |
ИАК % |
В 103кл/мл |
ИАК % |
В 103кл/мл |
ИАК % |
|
| 1 | 58,9 | 67,3 | 47,7 | 73,5 | 48,8 | 72,9 |
| 2 | 61,7 | 65,7 | 47,3 | 73,7 | 47,9 | 73,4 |
| 3 | 59,2 | 67,1 | 48,3 | 73,2 | 47,5 | 73,6 |
| ∑ | 59,9 | 66,7 | 47,8 | 73,5 | 48,1 | 73,3 |
При микроскопии флаконов с культурой клеток MDBK после 24 часов инкубирования выявлено наличие клеток полигональной формы, прикрепившихся к субстрату (рис. 3). Адгезия клеток MDBK, как и в случае с ЛЭЧ, была схожей для культур, инкубируемых в пластиковых флаконах и превышала значение индекса адгезии в культуре, инкубируемой в стеклянном флаконе (таблица 2). Отсюда можно сделать вывод, что клетки в обеих культурах прикреплялись к пластиковым флаконам лучше, чем к стеклянным. Возможно, это связано с более ровной поверхностью пластика. Однако, существенной разницы между индексами адгезии в пластиковых флаконах двух разных производителей не наблюдали.
Таблица 2. Индекс адгезии MDBK в трех параллелях.
| № пробы | Стеклянный флакон | Пластиковый флакон другого производителя | Пластиковый флакон ТРР | |||
| В 103кл/мл |
ИАК % |
В 103кл/мл |
ИАК % |
В 103кл/мл |
ИАК % |
|
| 1 | 56,9 | 35,3 | 48,2 | 45,2 | 47,4 | 46,1 |
| 2 | 54,5 | 37,9 | 49,3 | 43,9 | 47,8 | 45,7 |
| 3 | 56,7 | 35,6 | 49,6 | 43,7 | 47,3 | 46,7 |
| ∑ | 56,0 | 36,3 | 49,0 | 44,3 | 47,5 | 46,2 |
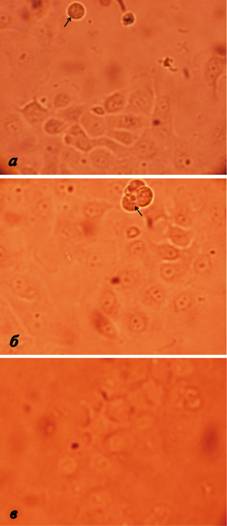
Рис. 3. Микроскопия MDBK после 24 часов инкубирования в флаконах TPP (а), и другого производителя (б) из пластика и стеклянных флаконах (в). После того, как клетки MDBK распластились по субстрату, они принимают полигональную нативную форму. Черные стрелочки указывают на округлые неприкрепившиеся клетки. Неприкрепившиеся клетки в стеклянном флаконе видно очень плохо из-за оптических свойств стекла.
Значение индекса пролиферации клеток ЛЭЧ-4/81 и MDBK, культивируемых в разных флаконах, было схожим для всех трех типов флаконов (таблица 2). Из этого следует, что пролиферативная активность клеток не изменилась в зависимости от культивирования на исследуемых видах субстрата.
Таблица 3. Индекс пролиферации клеток ЛЭЧ-4/81 и MDBK через 48 часов инкубирования.
| № пробы | Стеклянный флакон | Пластиковый флакон другого производителя | Пластиковый флакон ТРР | ||||||
| К1 | К2 | ИП | К1 | К2 | ИП | К1 | К2 | ИП | |
| ЛЭЧ-4/81 | 120,1 | 231,8 | 1,8 | 132,2 | 246,1 | 1,9 | 132,0 | 247,2 | 1,9 |
| MDBK | 32,0 | 49,7 | 1,6 | 39,0 | 61,7 | 1,6 | 40,5 | 64,8 | 1,6 |
При микроскопии клеток через 94 часа выявлено наличие монослоя MDBK и ЛЭЧ-4/81 во всех исследуемых флаконах (рис. 4).
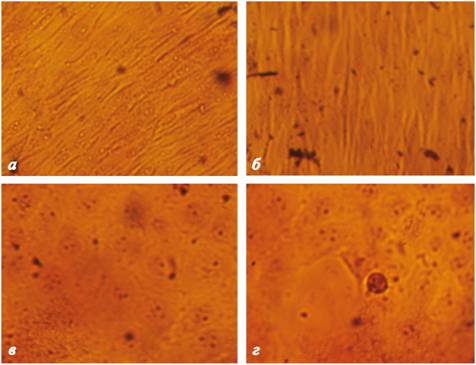
Рис. 4. Микроскопия сформировавшегося монослоя ЛЭЧ-4/81 (а, б) и MDBK (в, г) после 96 часов инкубирования в флаконах TPP (а, в), и другого производителя (б, г).
Выводы
Таким образом, оба вида пластиковых флаконов являются пригодными для культивирования клеточных культур, используемых в ветеринарной вирусологии. Однако следует отметить следующие положительные особенности пластика компании TPP: удобство маркировки, высокую прозрачность, удобную и четкую градуировку объема клеточных культур, а также то, что крышки флаконов удобно и плотно открываются и закрываются.
 Россия
Россия